
Kto potrzebuje badania genów BRCA1/2 na wczesnym etapie choroby?
W NINIEJSZYM ARTYKULE PORUSZONO NASTĘPUJĄCE ZAGADNIENIA:
-
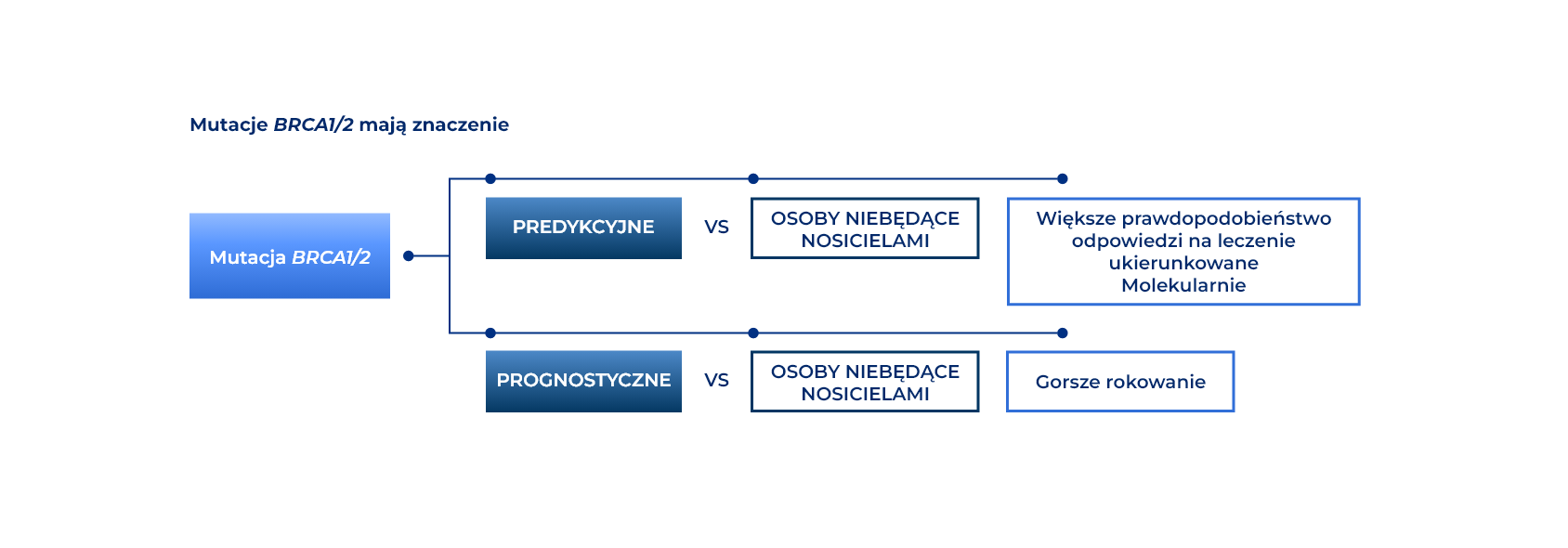
Testy predykcyjne i prognostyczne
-
U których pacjentów prawdopodobieństwo wystąpienia mutacji BRCA1/2 jest największe?
W wielu wytycznych dotyczących praktyki klinicznej podkreśla się znaczenie badania genów BRCA1/2 u pacjentów z uogólnionym opornym na kastrację rakiem prostaty (mCRPC) w celu podjęcia decyzji dotyczących leczenia i ustalenia działań zapobiegawczych dla rodziny pacjenta.
U wielu pacjentów z uogólnionym opornym na kastrację (mCRPC) występują zmiany w szlakach naprawy DNA, a mechanizm rekombinacji homologicznej (HRR) jest kluczowym mechanizmem naprawy DNA1,2. Geny BRCA1 i BRCA2 są najlepiej poznanymi elementami szlaku HRR, a w przypadku raka prostaty mutacje w genie BRCA2 występują częściej niż w BRCA1 2. Wiele innych genów jest bezpośrednio lub pośrednio zaangażowanych w HRR3.
Testy predykcyjne i prognostyczne
Ryzyko dziedziczne i wywiad rodzinny
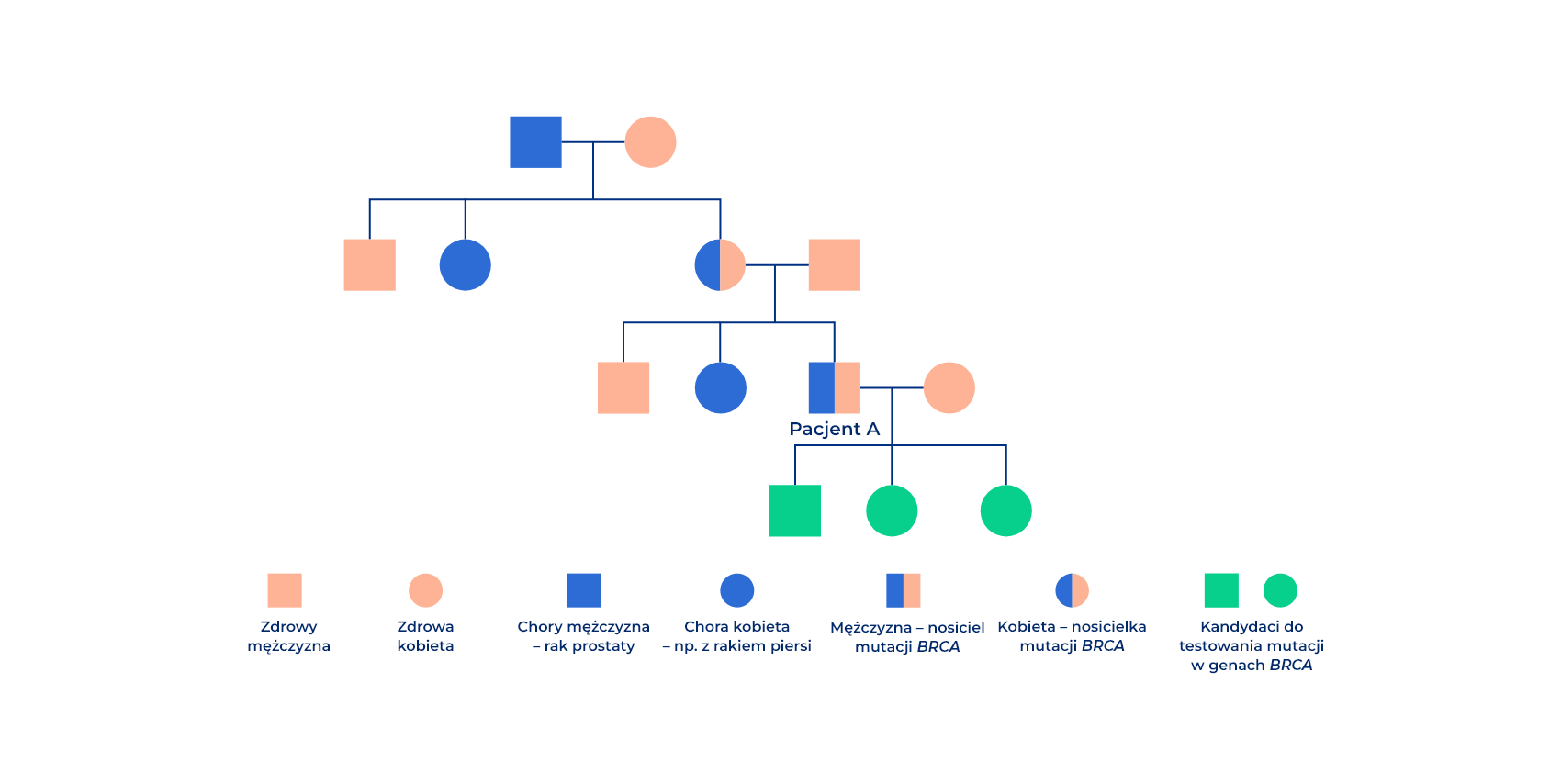
Pomimo że w wywiadzie rodzinnym nie odnotowano chorych na nowotwory BRCA – zależne (takich jak rak jajnika, piersi, prostaty czy trzustki) nie można wykluczyć nosicielstwa mutacji, które zwiększa ryzyko zachorowania na te choroby.
Na powyższym diagramie rodowodowym widać, że pacjent A jest nosicielem mutacji germinalnej w genach BRCA1/2 (gBRCA), mimo że jego rodzice nie mieli zdiagnozowanego raka. Dopiero gdy zagłębimy się w historię rodziny pacjenta, okaże się, że u dziadka pacjenta A zdiagnozowano raka prostaty, co najprawdopodobniej było przyczyną wystąpienia mutacji BRCA1/2 u pacjenta A. W związku z tym pacjent A mógł przekazać tę mutację swojemu potomstwu, co czyni je pierwszymi kandydatami do testu BRCA1/2.
Pacjenci mogą być nieświadomi obecności mutacji BRCA1/2 u członków rodziny, dlatego warto wykonać badanie BRCA1/2, nawet jeśli u członka najbliższej rodziny nie zdiagnozowano nowotworu.
Wytyczne dotyczące praktyki klinicznej, takie jak wytyczne NCCN, ESMO, AUA/ASTRO/SUO, Philadelphia Prostate Cancer Consensus 2019 Conference, APCCC i EAU, zawierają zalecenia dotyczące oceny ryzyka genetycznego (badania identyfikujące mutacje germinalne i/lub somatyczne, w genach BRCA1 lub BRCA2).
U których pacjentów prawdopodobieństwo wystąpienia mutacji BRCA1/2 jest największe?
Na podstawie różnych badań szacuje się, że w populacji pacjentów z przerzutowym opornym na kastracje z rakiem prostaty (mCRPC) częstość występowania mutacji w genach BRCA1 i BRCA2 utrzymuje się na poziomie 9,7%4.
Około 50% mutacji pochodzi z linii germinalnej (pozostałe 50% jest zatem pochodzenia somatycznego), a BRCA2 jest najczęściej występującą mutacją u pacjentów z rakiem prostaty1,2,5-8.
Ponadto dostępne dane wskazują, że mutacje w genach BRCA1/2 powstają na wczesnym etapie choroby w tkance nowotworowej i nie zmieniają się w trakcie progresji choroby, co pozwala nam na wykorzystanie tkanek archiwalnych, z materiału pierwotnego do identyfikacji tych mutacji9.
Dodatkowo, zmiany w zakresie naprawy DNA występują w większym stopniu w przypadku raka prostaty z przerzutami niż w przypadku raka miejscowo zlokalizowanego — co stanowi dowód na to, że badanie wolnokrążącego DNA (ctDNA) może być alternatywą do badania tkanki nowotworowej w przypadku problemów z jej pozyskaniem10.
W wielu wytycznych dotyczących raka prostaty sformułowano zalecenia dotyczące terapii celowanej u pacjentów z rakiem prostaty i germinalną bądź somatyczną mutacją w genach BRCA1/21,11.
Wytyczne towarzystw różnią się nieznacznie w kontekście tego, kiedy dokładnie należy wykonać badania genów BRCA1/2, jednak konsensus jest wspólny i wskazuje, że im szybciej wykonamy badanie, tym większa będzie korzyść dla pacjenta.
Chociaż średnia czasu do uzyskania wyniku badania BRCA1/2 jest różna w zależności od kraju czy laboratorium, publikacje naukowe wskazują, że aby pomóc w podjęciu decyzji o leczeniu, badania te powinny być wykonane jak najwcześniej, a oczekiwanie na wynik nie powinno przekraczać 4 tygodni12.13. NGS jest obecnie najdokładniejszą metodą oznaczającą mutacje w genach BRCA1/212,13. Określenie statusu mutacji w genach BRCA1/2 jest ważne w celu wskazania najbardziej optymalnego leczenia dostępnego dla pacjenta14-20.
Referencje:
- Annala M et al. Treatment Outcomes and Tumor Loss of Heterozygosity in Germline DNA Repair-deficient Prostate Cancer. Eur Urol. 2017;72(1):34-42.
- ESMO 2019: Central, Prospective Detection of Homologous Recombination Repair Gene Mutations in Tumor Tissue from >4000 Men with mCRPC Screened for the PROfound Study. Online: https://www.urotoday.com/conference-highlights/esmo-2019/esmo-2019-prostate-cancer/115255-esmo-2019-central-prospective-detection-of-homologous-recombination-repair-gene-mutations-in-tumour-tissue-from-4000-men-with-mcrpc-screened-for-the-profound-study.html [dostęp:22.01.2024].
- Wright WD et al. Homologous recombination and the repair of DNA double- strand breaks. J Biol Chem. 2018;293(27):10524-10535.
- de Bono J et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2020;382(22):2091-2102.
- Na R et al. Germline Mutations in ATM and BRCA1/2 Distinguish Risk for Lethal and Indolent Prostate Cancer and are Associated with Early Age at Death. Eur Urol. 2017;71(5):740-747.
- Pritchard CC et al. Inherited DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med. 2016;375(5):443-453.
- Lang SH et al. A systematic review of the prevalence of DNA damage response gene mutations in prostate cancer. Int J Oncol. 2019;55(3):597-616.
- Nicolosi P et al. Prevalence of Germline Variants in Prostate Cancer and Implications for Current Genetic Testing Guidelines. JAMA Oncol. 2019;5(4):523.
- Mateo J et al. Genomics of lethal prostate cancer at diagnosis and castration resistance. J Clin Invest. 130(4):1743-1751.
- Armenia J et al. The long tail of oncogenic drivers in prostate cancer. Nat Genet. 2018;50(5):645-651.
- EAU-ESUR-ESTRO-SIOG-Guidelines-on-Prostate-Cancer-large-text-V2. Online: https://www.europeanurology.com/article/S0302-2838(20)30769-7/fulltext [Dostęp:22.01.2024].
- Park HS et al. Next-generation sequencing of BRCA1/2 in breast cancer patients: potential effects on clinical decision-making using rapid, high-accuracy genetic results. Ann Surg Treat Res. 2017;92(5):331-339.
- Toland AE et al. Clinical testing of BRCA1 and BRCA2: a worldwide snapshot of technological practices. Npj Genomic Med. 2018;3(1):1-8.
- Mosele F et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol Off J Eur Soc Med Oncol. 2020;31(11):1491- 1505.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Genetic/Familial High-Risk Assessment: Breast, Ovarian and Pancreatic V2.2021. National Comprehensive Cancer Network, Inc. All rights reserved. Online: https://nccn.org [dostęp:22.01.2024].
- Parker C et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, treatment and follow-up†. Ann Oncol. 2020;31(9):1119-1134.
- American Urological Association. Advanced Prostate Cancer: AUA/ASTRO/SUO Guideline. Online: https://www.auanet.org/guidelines/guidelines/advanced-prostate-cancer [Dostęp:22.01.2024].
- Giri VN et al. Implementation of Germline Testing for Prostate Cancer: Philadelphia Prostate Cancer Consensus Conference 2019. J Clin Oncol Off J Am Soc Clin Oncol. 2020;38(24):2798-2811.
- Gillessen S et al. Management of Patients with Advanced Prostate Cancer: Report of the Advanced Prostate Cancer Consensus Conference 2019. Eur Urol. 2020;77(4):508-547.
- Cornford P et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer. Part II-2020 Update: Treatment of Relapsing and Metastatic Prostate Cancer. Eur Urol. 2021;79(2):263-282
Dowiedz
się więcej
Dowiedz się czym dokładnie jest BRCA1/2 i co zrobić, aby
zadbać o siebie i bliskich.